类器官之父最新论文:利用人类气道黏膜下腺体类器官研究炎症和感染,一作已回国加入中国科学院
来源:生物世界 2025-06-15 11:49
该研究开发了人类气道黏膜下腺体(SMG)类器官,用于研究呼吸系统炎症和感染。
2009 年,荷兰皇家艺术与科学院 Hubrecht 研究所的 Hans Clevers 等人使用来自小鼠肠道的成体干细胞培育出首个肠道类器官,开创了类器官研究时代。此后,类器官领域研究成果不断,许多新型类器官和更复杂的类器官不断涌现,为新药研发、精准治疗、再生医学等领域带来了更强大的工具。
2025 年 6 月 12 日,Hans Clevers 教授团队(林琳为第一作者兼共同通讯作者)在 Cell 子刊 Cell Stem Cell 上发表了题为:Human airway submucosal gland organoids to study respiratory inflammation and infection 的研究论文。
该研究开发了人类气道黏膜下腺体(SMG)类器官,用于研究呼吸系统炎症和感染。

人体气道内衬有两种截然不同的上皮结构:一种是覆盖呼吸道表面区域的纤毛上皮——表面气道上皮(SAE),另一种是嵌入所有软骨气道黏膜下空间的黏液分泌腺——气道黏膜下腺体(SMG)。
表面气道上皮(SAE)由四种主要细胞类型组成:基底细胞、纤毛细胞、棒状细胞和产 MUC5AC 黏液细胞。这一层发挥着物理屏障作用,并有助于黏液纤毛清除。相比之下,气道黏膜下腺体(SMG)主要位于气管和大支气管,主要由产 MUC5B 黏液细胞、浆液细胞、基底细胞和肌上皮细胞组成。SMG 负责分泌黏液和多种抗菌肽,这对于保持气道湿度以及抵御病原体至关重要。这种细胞异质性不仅有助于 SMG 在黏液分泌方面的主要作用,还对其对炎症刺激和病原体的复杂反应有所贡献。
近期的研究显示,在小鼠模型中,SMG 有助于气道上皮损伤后的修复和再生,这表明其可能是多能祖细胞的一个潜在储备库,能够分化为多种气道细胞类型。这种再生能力使 SMG 在健康和疾病中都具有重要意义,尤其是在慢性阻塞性肺疾病(COPD)等病症中,这类病症中气道重塑和慢性炎症十分常见。事实上,SMG 肥大被认为是 COPD 气道的主要病理生理变化之一,会导致黏液分泌过多、气道阻塞以及肺损伤加重。
尽管其具有重要意义,但除了来自人类或动物模型的短暂存活的组织外植体培养外,目前还没有来自人类成年组织的稳健的 SMG 体外模型。基于类器官的人类气道疾病建模主要集中于更容易获取的表面气道上皮(SAE)。
鉴于 SMG 在黏液生成和宿主防御中的关键作用,研究团队从 SAE 和 SMG 区域的初级支气管组织中建立了人类类器官,以探究它们独特的生理特性。
单细胞 RNA 测序(scRNA-seq)分析证实,这些类器官模型准确地重现了每种组织类型固有的细胞异质性。具体而言,SMG 类器官富含产 MUC5B 黏液细胞,并且还会生成表达α-平滑肌肌动蛋白(αSMA)的肌上皮细胞。
ANPEP/CD13 特异性地标记 SMG 的分泌细胞,细胞因子的暴露会在 SMG 的分泌细胞中引发不同的炎症转录组反应。用人类 α 冠状病毒 229E(HCoV-229E)进行的感染实验表明,CD13 阳性的分泌细胞具有选择性易感性,从而引发未折叠蛋白反应。这些发现拓宽了气道类器官在模拟呼吸生理学/病理学方面的应用范围。
该研究的亮点:
-
人类支气管组织来源的黏膜下腺体类器官的培养;
-
ANPEP/CD13 是腺体分泌细胞的特异性标志物;
-
慢性阻塞性肺疾病(COPD)相关的细胞因子引发不同的炎症反应;
-
人类 α 冠状病毒 229E(HCoV-229E)主要感染腺体分泌细胞。
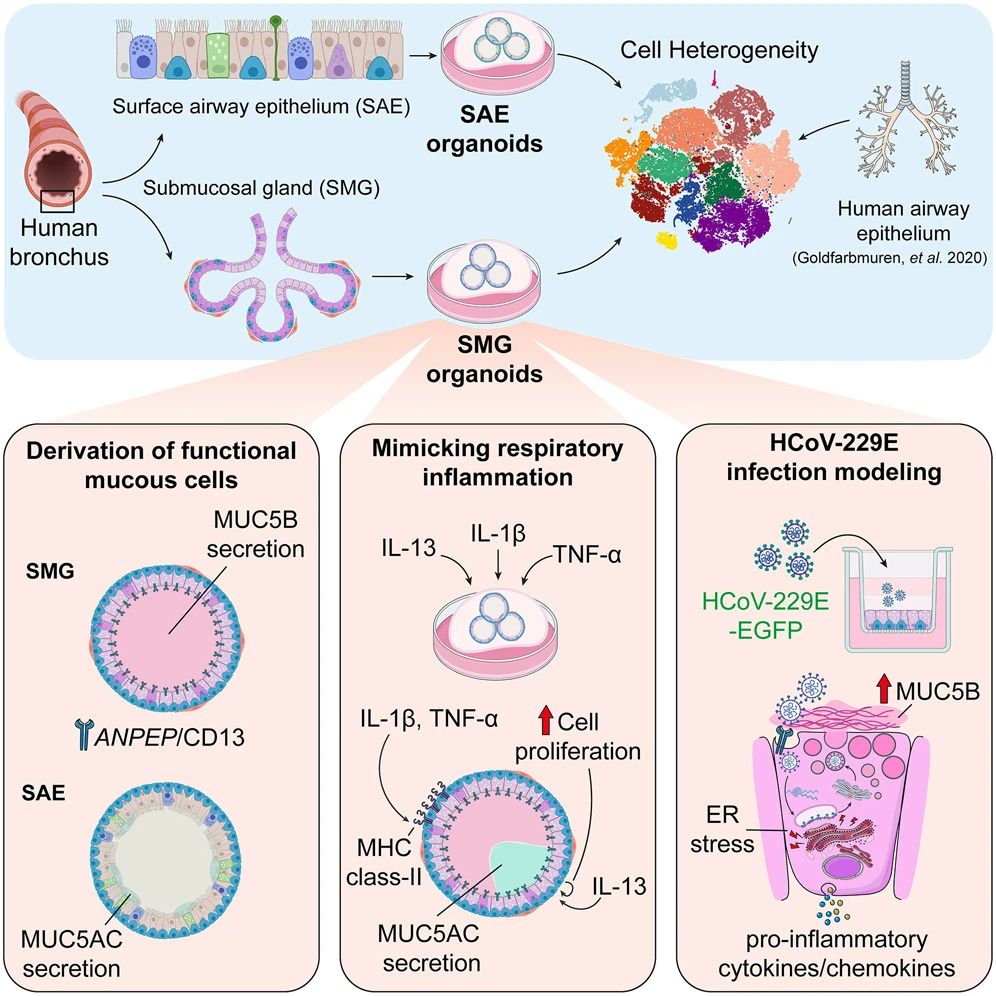
总的来说,该研究确立了 SMG 类器官模型作为探究人类气道中 SMG 复杂作用的新工具。SMG 类器官模型有效地再现了关键的腺体细胞类型,并且与 SAE 类器官一起,为研究细胞对感染和炎症刺激的反应提供了一个更具生理相关性的系统。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


